Research
2.各種疾患関連タンパク質に結合する抗体や阻害剤の認識メカニズムの解明
1) 抗Epiregulin抗体9E5によるEpiregulin認識機構の解明
2) ROBO1 Fn3ドメインと抗体複合体における分子表面チロシン残基の構造的特徴
1) 抗Epiregulin抗体9E5によるEpiregulin認識機構の解明
J. Biol. Chem., 291 2319-2330 (2016)
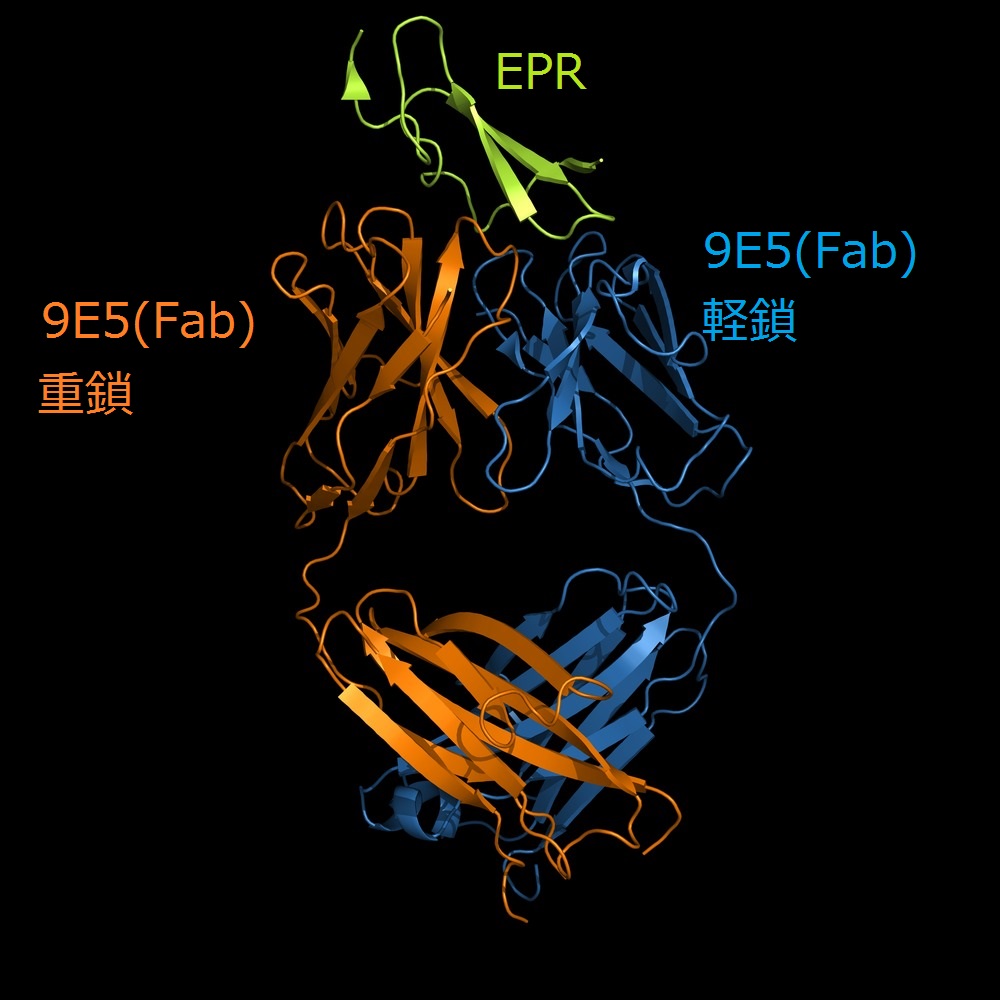
図1:EPR-9E5(Fab)の全体構造
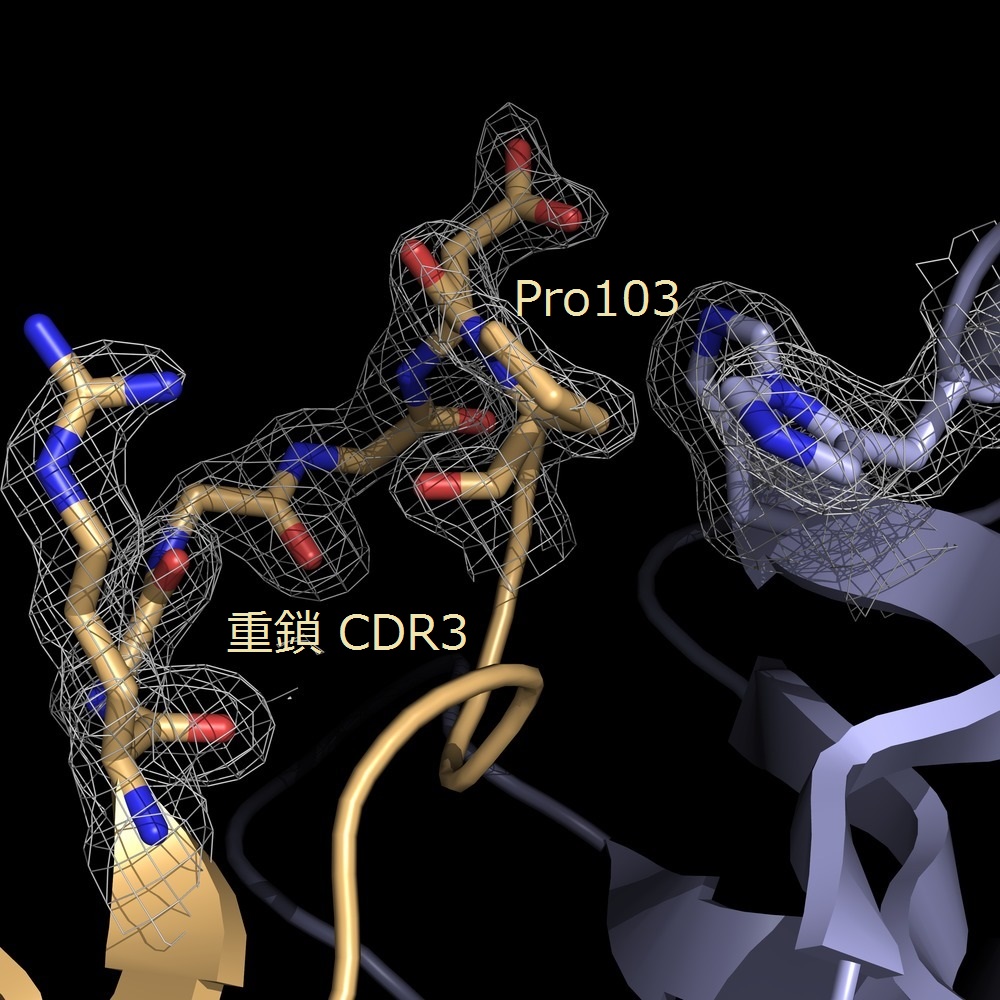
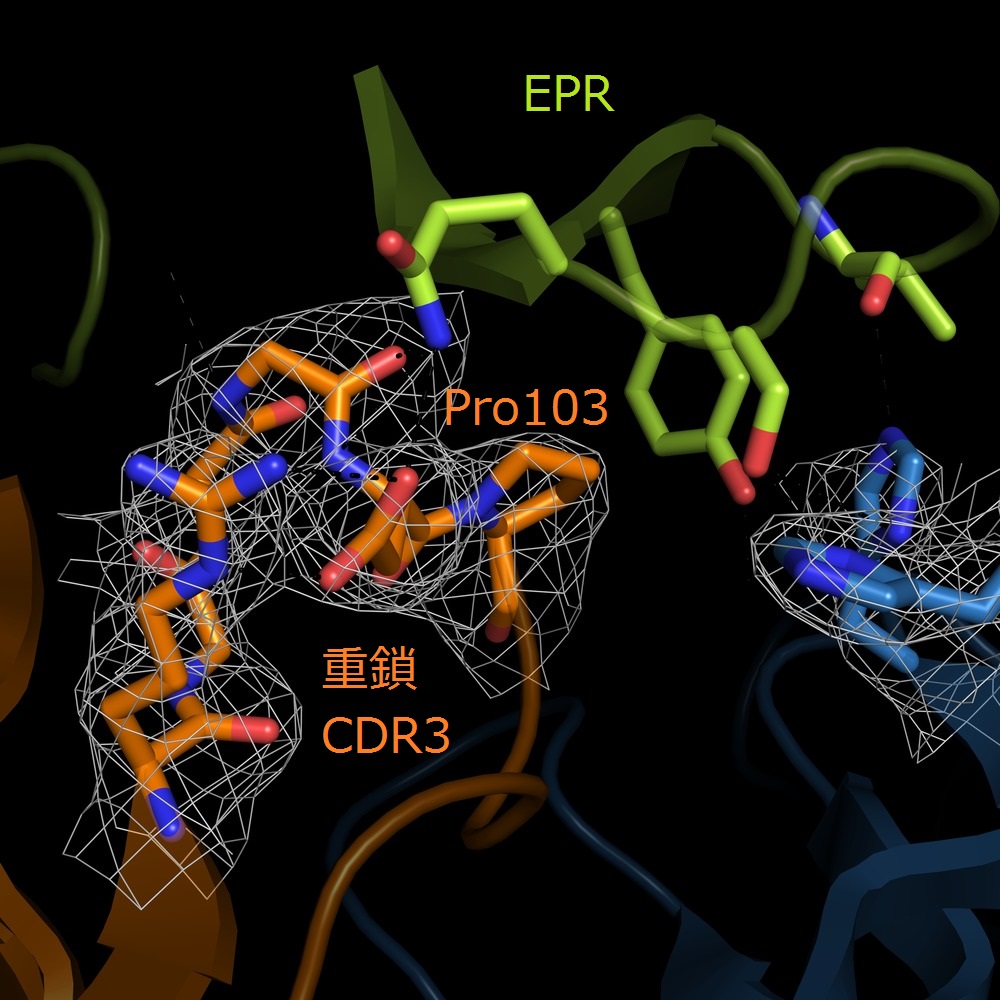
図2:9E5(Fab)(上),EPR結合型9E5(Fab)(下)
の重鎖CDR3近傍の構造
Epiregulin(EPR) は上皮細胞成長因子ファミリーに属する増殖因子であり、Epidermal growth factor receptor(EGFR)シグナル伝達経路のリガンドです。EPRは膜貫通型糖蛋白質受容体であるEGFRに結合し、EGFRの二量化を促進します。その結果EGFR細胞内キナーゼドメインが自己リン酸化されます。リン酸化シグナルはmitogen-activated protein kinase (MAPK) 経路、 phosphoinositide 3-kinase (PI3K) Akt経路、STAT5経路を介して伝達され、細胞の分化、抗アポトーシス、血管新生などを誘発するため1-3、EPR等の増殖因子やEGFRの遺伝子・蛋白質レベルでの過剰発現は、がんと深く関わっています。EPRは特に大腸がん細胞で多く発現している為、その抗体やScFvは、大腸がんマーカーや抗体医薬品への応用が期待されます。
我々は抗EPR抗体9E5のFabのEPR非結合型・結合型構造を、分解能1.6 Å、2.5 Åでそれぞれ構造決定しました(図1) 。両構造を比較した結果、9E5(Fab)の重鎖CDR3上のPro103がEPRの結合により、Cis-Trans転移を起こし、ループ構造を変化させていることが明らかとなりました(図2)。
またSPR・ITC解析により、9E5抗体のEPRに対するKD値は0.86~6.5 nMであり、結合解離が遅く、抗原をはずしにくい特性を持つことが確認できました。GROMACSによるMDシミュレーションとEPR変異体を用いたITC解析より、9E5抗体の重鎖CDR2とEPRのArg40の相互作用が必須であることが解明されました。
以上より9E5抗体はEPRに対し高い親和性を示し、その結合の解離は非常に遅いことが明らかになりました。その原因として、9E5抗体によるEPRのArg40との相互作用や、高い活性化エネルギーを必要とするPro103のCis-Trans転移を伴う、重鎖CDR3のコンホメーション変化が関与すると考えられます。
(Reference)
1 Yarden, Y. & Sliwkowski, M. X. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2, 127-137, doi:10.1038/35052073 (2001).
2 Fischer, O. M., Hart, S., Gschwind, A. & Ullrich, A. EGFR signal transactivation in cancer cells. Biochem Soc Trans 31, 1203-1208, doi:10.1042/ (2003).
3 Yu, H. & Jove, R. The STATs of cancer--new molecular targets come of age. Nat Rev Cancer 4, 97-105, doi:10.1038/nrc1275 (2004).
2) ROBO1 Fn3ドメインと抗体複合体における分子表面チロシン残基の構造的特徴
Protein Sci. 24(3) 328-340 (2015)
Coming Soon...

